IDENTIFICACIÓN Y CARACTERIZACIÓN DE ALÉRGENOS. PRODUCCIÓN RECOMBINANTE DE PROTEÍNAS ALERGÉNICAS. HERRAMIENTAS DIAGNOSTICAS EN MEDICINA PERSONALIZADA
|
Descripción |
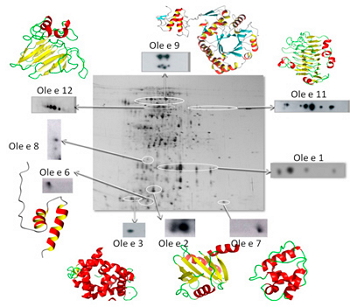
Figura 1. Identificación en una electroforesis bidimensional de los alérgenos del polen de olivo.
Identificación y aislamiento de alérgenos. La incidencia de la alergia, problema de salud de primer orden, está en continuo crecimiento y afecta ya a aproximadamente el 30% de la población de los países desarrollados. Las aportaciones científicas realizadas por nuestro grupo han contribuido a mejorar de forma considerable el diagnóstico al permitir identificar las moléculas responsables de la reacción y diseñar así un tratamiento mejor para combatirla.Disponemos de más de 30 proteínas puras que han permitido evaluar el agente causante de la sensibilización y síntomas clínicos de los pacientes, y la probabilidad de que a través de esas moléculas se puedan provocar progresivamente más sensibilizaciones (fenómeno conocido como reactividad cruzada). Este fenómeno origina una visión muy compleja (alergia a un gran número de fuentes alergénicas) de un problema muy simple (la sensibilización a una sola proteína). En el campo de la alergia a alimentos, la detección de alérgenos ocultos -como los de la mostaza o el cacahuete, y la identificación de alérgenos en partes específicas de los frutos y vegetales -por ejemplo, en las semillas del tomate o el kiwi, o en la piel del melocotón-, que ocasionan reacciones inesperadas entre la población alérgica, junto con la disponibilidad de extractos alergénicos estandarizados, en los que todos los alérgenos se encuentren representados en la proporción adecuada, serían críticos para un correcto diagnóstico de los pacientes. Los pólenes, en ciertas épocas del año, también son una fuente muy común de alergias respiratorias. Una vez que entran en las vías aéreas, pueden causar síntomas muy molestos y a veces realmente graves. Nuestro grupo de investigación ha aportado a la clínica más de 20 alérgenos de pólenes de olivo, fresno, salsola y quenopodio para ser utilizados como herramientas diagnósticas.
Expresión biológica en sistemas heterólogos de DNAs que codifican proteínas alergénicas. Otro objetivo importante es la obtención de alérgenos de calidad en cantidades apreciables, para poder introducirlas en el mercado farmacéutico y usarlas a nivel clínico. Las herramientas de Biología Molecular e Ingeniería Genética nos han permitido producir alérgenos recombinantes en sistemas inocuos y sencillos como bacterias o levaduras, y así poder subir la escala de producción y llegar a obtener varios cientos de miligramos de un alérgeno particular. Sin embargo, es imprescindible llevar a cabo la validación de la calidad de estas moléculas recombinantes confirmando su equivalencia con las proteínas naturales obtenidas a partir de polen o fruto.
Uso de bibliotecas de fagos (Phage Display) y micromatrices (microarrays) de proteínas. Esta potente tecnología de cribado ha dado pie a un gran número de avances en el campo de la alergia y de otras patologías, como el cáncer y ha permitido mapear los epítopos IgE e IgG e incluso identificar proteínas alergénicas de difícil detección por otras técnicas. Estas técnicas combinadas con otras tecnologías ómicas nos han permitido completar los paneles de alérgenos, a veces extremadamente complejos, de fuentes clínicamente relevantes.
|
¿Cómo funciona? |
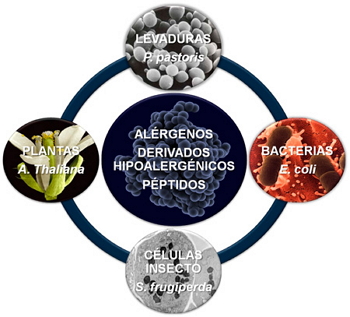
Figura 2.Sistemas de expresión utilizados para producir proteínas recombinantes.
Se trata de purificar proteínas a partir del material biológico pólenes y alimentos vegetales- las proteínas responsables de la sensibilización de los pacientes. En el laboratorio tenemos una amplia experiencia de más de 30 años en la purificación y caracterización de proteínas, mediante sistemas cromatográficos convencionales y otros más sofisticados como HPLC o FPLC. Mediante electroforesis bidimensional (Figura 1) se puede determinar la masa molecular, el punto isoeléctrico y el grado de polimorfismo de un alérgeno particular.
Se trata de aislar el RNA mensajero que codifica para una proteína concreta y obtener su correspondiente DNA complementario (cDNA). Este cDNA, previamente amplificado por PCR, se inserta en un vector génico que, replicado en una célula huésped, sirve de vehículo de expresión para la producción de una molécula recombinante. Una vez transformadas con el vector las células del huésped (en general bacterias -Escherichia coli-, o levaduras -Pichia pastoris-, células de insecto –vía infección con Baculovirus- o plantas (Arabidopsis thaliana)) (Figura 2), el cultivo se hace crecer hasta que alcanza unos niveles de producción adecuados de la proteína recombinante.
En ocasiones, para facilitar las distintas etapas del proceso, la inducción y posterior aislamiento, es conveniente expresar el DNA de la proteína objetivo junto con el codificante para otra cadena polipeptídica, que puede ser la de una proteína completa o bien un fragmento peptídico. En ese caso, se produce una proteína de fusión. Posteriormente, la proteína así producida debe ser purificada hasta homogeneidad, para lo cual se hace uso de sus propiedades químico-físicas, peso molecular, solubilidad, carga, etc.
Para que la proteína recombinante sustituya eficazmente a la proteína obtenida de la fuente biológica natural, es esencial comprobar que sus propiedades moleculares son equivalentes. Por ese motivo, la caracterización estructural y funcional de la proteína recombinante es una etapa crítica a la hora de valorar el sistema de expresión utilizado.
|
Ventajas |
La expresión recombinante de DNA proporciona un sistema de producción ilimitada de proteínas altamente homogéneas cuya presencia en la naturaleza sea escasa o, en todo caso, su aislamiento implique dificultades. Además se pueden preparar, por mutagénesis dirigida, derivados de esas moléculas que posean propiedades de estabilidad o actividad biológica modificadas.
|
¿Dónde se ha desarrollado? |
Estas tecnologías han sido desarrolladas en el Departamento de Bioquímica y Biología Molecular de la Facultad de CC. Químicas de la Universidad Complutense de Madrid. Más de 30 años lleva nuestro grupo utilizando sistemas de producción de proteínas tanto purificadas a partir de sus fuentes biológicas como en forma recombinante. Más de 20 proteínas se han producido en E. coli, y más de 15 en P. pastoris y Baculovirus, como sistemas de expresión. Estos alérgenos se han purificado, y el análisis de sus propiedades estructurales y funcionales ha mostrado que son equivalentes a las correspondientes formas producidas en la naturaleza. El grupo tiene más de 160 publicaciones en revistas de impacto medio-alto del área de bioquímica y biología molecular, biotecnología, inmunología y biomedicina (New England Journal of Medicine, Journal of Allergy and Clinical Immunology, Journal of Immunology, Journal of Biological Chemistry, PNAS, Allergy, Molecular Immunology, Clinical and Experimental Allergy, Biochemical Journal, FEBS Journal, Protein Science, Journal of Biotechnology, Protein Expresión and Purification, FEBS Lett., BBA, Molecular Nutrition and Food Research). Se han presentado más de 20 Tesis Doctorales y 20 proyectos regionales, nacionales y europeos, además de numerosos proyectos de Artículo 83 con Empresas y Fundaciones. Se tienen 7 patentes con Licencia española y se han recibido varios premios de Divulgación.
|
Y además |
Durante los últimos años, la alergia se ha definido como una disfunción de la barrera epitelial que actúa como interfase entre nuestros ambientes interno y externo. En el caso particular de pacientes asmáticos, se ha observado una alteración en la barrera epitelial respiratoria. El estudio de cómo influye el estado fisiológico del epitelio respiratorio en la respuesta inmune frente a aeroalérgenos y cuáles son los factores que actúan de forma sinérgica con estas moléculas, así como la implicación en la interacción del surfactante pulmonar -la mezcla lípido-proteína que recubre los alveolos de los pulmones- constituyen otra de nuestras líneas de investigación que ha requerido poner a punto nuevas técnicas de cultivos celulares y de microscopía. Utilizamos varias técnicas entre las que destacan las proteómicas y genómicas a gran escala para obtener un perfil diferencial de proteínas, mRNA y miRNA que nos permita profundizar en el conocimiento de la respuesta alérgica frente a aeroalérgenos, y así poder diseñar nuevas estrategias terapéuticas para el tratamiento de la alergia.
Por último, otra de nuestras líneas de investigación se centra en el estudio de la relación entre la enfermedad neurodegenerativa de Alzheimer y la alergia, dos desórdenes clínicos de carácter crónico. Los vínculos entre estas dos enfermedades parecen estar asociados a moléculas como citoquinas pro-inflamatorias, altos niveles de IgG e IgE en el cerebro y la fosforilación de proteínas relacionadas con dichas enfermedades. Además, se da la circunstancia de que existe una sorprendente relación estructural entre proteínas relacionadas con el Alzheimer y con la de determinados alérgenos. Por tanto, nuestro trabajo tiene como principal objetivo estudiar la reactividad inmunológica cruzada existente entre ambos tipos de moléculas, utilizando las técnicas de alto rendimiento anteriormente mencionadas: bibliotecas de fagos y microarrays de proteínas. Este objetivo puede arrojar luz para lograr un diagnóstico preciso de ambas enfermedades, y tal vez para el diagnóstico personalizado, terapia y monitorización de los pacientes.
Nuestro posible papel de colaboración se enfocaría hacia la adaptación de estos sistemas a las necesidades del cliente, esto es, diseñar los protocolos para el aislamiento de la proteína de acuerdo con los requerimientos de calidad o cantidad que nos sean informados. Producción, mutagénesis y obtención de proteínas modificadas, de derivados análogos a la proteína natural que respondan a necesidades concretas del cliente. Posibilidad de asesoramiento para la incorporación de la metodología a la empresa contratante.
|
Contacto |
|
© Oficina de Transferencia de Resultados de Investigación – UCM |
|
Descargas PDF |
|
Clasificación |
|
Investigadora responsable |
Mayte Villalba Díaz: mvillalb@ucm.es
Departamento: Bioquímica y Biología Molecular I
Facultad: Ciencias Químicas


