ANÁLISIS ESTRUCTURAL Y FUNCIONAL DE PROTEÍNAS HIDROSOLUBLES Y PROTEÍNAS DE MEMBRANA. EMPLEO DE NANODISCOS.
|
Descripción |
El grupo está especializado en el análisis funcional y estructural de proteínas utilizando como herramientas distintas espectroscopías (absorción, fluorescencia y dicroísmo circular) y aproximaciones químico-físicas (calorimetría, ultracentrifugación), con especial hincapié en proteínas capaces de interaccionar con membranas biológicas y/o integrarse en ellas. Este análisis incluye ensayos enzimáticos si se trata de enzimas y otros ensayos funcionales, como medidas de hemolisis, fusión de lípidos o pérdida de contenidos acuosos, si se trata de otro tipo de proteínas. Somos pioneros en la preparación y caracterización de nanodiscos, una metodología que permite el análisis de proteínas de membrana en disolución, integradas en bicapas lipídicas idénticas a las naturales y sin el empleo de detergentes.
|
¿Cómo funciona? |
Las proteínas poseen dos tipos de cromóforos (grupos químicos capaces de interaccionar con luz): el propio enlace peptídico, consustancial a la formación de una cadena polipeptídica, y las cadenas laterales de sus aminoácidos aromáticos. Las propiedades espectroscópicas de los cromóforos dependen no sólo de su estructura, sino de su entorno. Por ese motivo, el análisis espectroscópico de proteínas revela información estructural inequívoca acerca de la conformación nativa de una proteína en disolución, utilizando cantidades que rondan los 100 µg de muestra. Si cambia la estructura de una proteína, cambiará el entorno de sus cromóforos y, por tanto, sus propiedades espectroscópicas. Esta información es todavía más determinante si las proteínas se encuentran en un medio hidrofóbico, como el seno de una membrana lipídica.
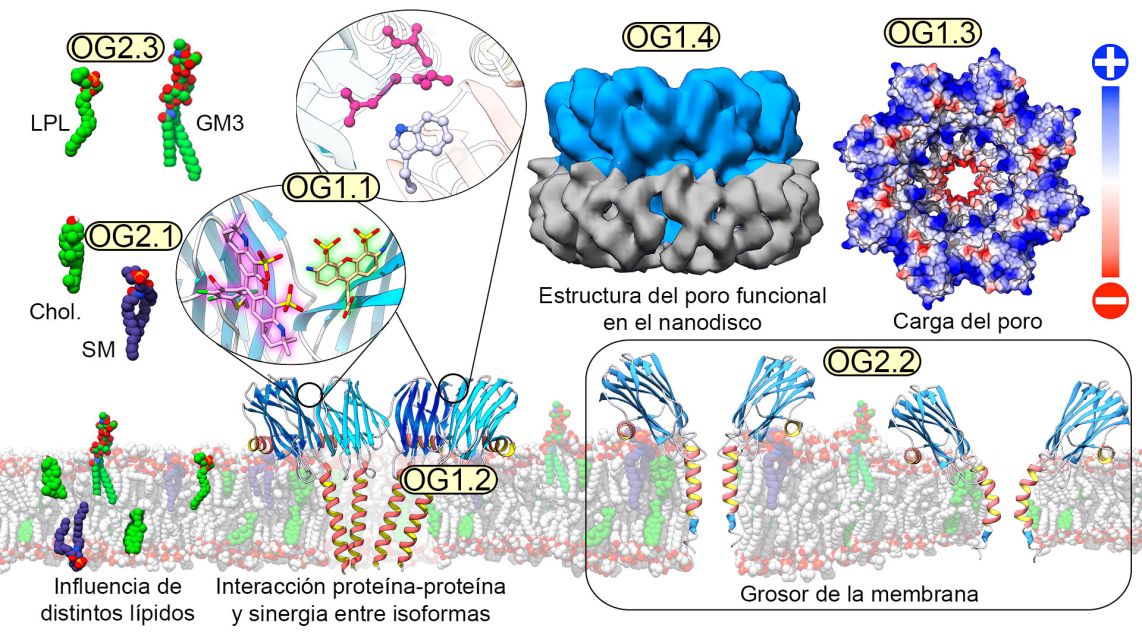
La figura resume la diversidad de situaciones que permite analizar la metodología ofertada, desde el empleo de gran diversidad de lípidos hasta la determinación de la estructura tridimensional de proteínas de membrana insertadas en nanodiscos, pasando por el estudio local de las interacciones que se producen, bien entre la proteína y los lípidos, bien entre ésta y otras unidades proteicas. Es además posible el estudio de múltiples parámetros biofísicos y termodinámicos relacionados con el grosor de la membrana, su fluidez, su permeabilidad o la existencia de dominios locales bien diferenciados.
Se dispone de toda una batería de ensayos encaminados al estudio de las proteínas con vesículas modelo, algunas de gran complejidad lipídica, basadas asimismo en el cambio de propiedades de sondas fluorescentes integradas en dichas membranas. Las medidas de calorimetría revelan además los parámetros termodinámicos que gobiernan estas interacciones.
Por último, se ha optimizado la preparación de nanodiscos. Estos nanodiscos son partículas lipídicas, con estructura de bicapa lamelar, pero completamente solubles en agua. Estas estructuras permiten el estudio de proteínas de membrana que, de otra forma, sería imposible manejar en disolución sin el empleo de detergentes.
|
Ventajas |
Una de las principales ventajas de las técnicas desarrolladas en el grupo es el escaso material necesario para llevar a cabo el análisis. En muchos casos, ese análisis ni siquiera es destructivo, de forma que el material empleado se recupera por completo una vez analizado. Hay muy pocos grupos en el territorio nacional español con la instrumentación y el bagaje necesarios para llevar a cabo este análisis tan diverso y completo, muy especialmente en lo que se refiere al estudio de proteínas que se asocian a las membranas biológicas. Su insolubilidad suele hacer necesario el empleo de detergentes, que no forman estructuras lamelares y, por ello, no mimetizan correctamente una membrana biológica. La utilización de nanodiscos, impulsada por nosotros, supone otra gran ventaja porque resuelve este problema. Se debe recordar que la mayoría de los receptores con interés farmacológico son precisamente proteínas integrales de membrana, por ejemplo.
|
¿Dónde se ha desarrollado? |
El desarrollo de esta tecnología se ha llevado a cabo en el seno del grupo de investigación del Departamento de Bioquímica y Biología Molecular de la Facultad de Ciencias Químicas que se autodenomina como “Grupo de proteínas tóxicas”. Este grupo tiene un bagaje científico de más de 30 años de experiencia dedicados a la utilización y optimización de las metodologías que se ofertan, que se plasma en más de 200 artículos de investigación y 5 patentes (una de ámbito mundial, otra europea y tres de aplicación a nivel nacional).
|
Y además |
Además de la tecnología ofertada, el grupo es capaz de producir en gran cantidad (decenas de miligramos) las proteínas estudiadas, utilizando sistemas heterólogos como las bacterias Escherichia coli y Lactococcus lactis y la levadura Pichia pastoris. Estos dos últimos organismos son además considerados como GRAS (Generally Regarded As Safe), una condición que facilita enormemente la comercialización de las proteínas producidas.
Vídeo del grupo de investigación
|
Contacto |
|
© Oficina de Transferencia de Resultados de Investigación – UCM |
|
Descargas PDF |
|
Clasificación |
|
Investigadores responsables |
Álvaro Martínez del Pozo: alvaromp@quim.ucm.es
Departamento: Bioquímica y Biología Molecular
Facultad: Ciencias Químicas
Sara García-Linares: sglinares@ucm.es
Departamento: Bioquímica y Biología Molecular
Facultad: Ciencias Biológicas


