Investigación
Líneas de Investigación
Estructura y dinámica de las interfases de hielo
La interfase entre el hielo y el aire presenta un comportamiento fascinante de enorme importancia en las ciencias atmosféricas, en la geofísica y en la ciencia de las interfases en general.
Un ejemplo es el caso de los cristales de nieve, como se describe en este video de divulgación. Los estudios pioneros del científico japonés Ukichiro Nakaya demostraron que su forma depende tanto de la temperatura como de la humedad de la atmósfera y presentan una serie de cambios muy curiosos dependiendo especialmente de la temperatura. Cerca de los 0 grados, tienen forma chata. Pero si aumenta la temperatura tan solo cuatro grados, adoptan mayoritariamente forma columnar. Este cambio ocurre otras dos veces más seguín disminuye la temperatura. El diagrama que determina sus formas recibe el nombre de Diagrama de Nakaya.
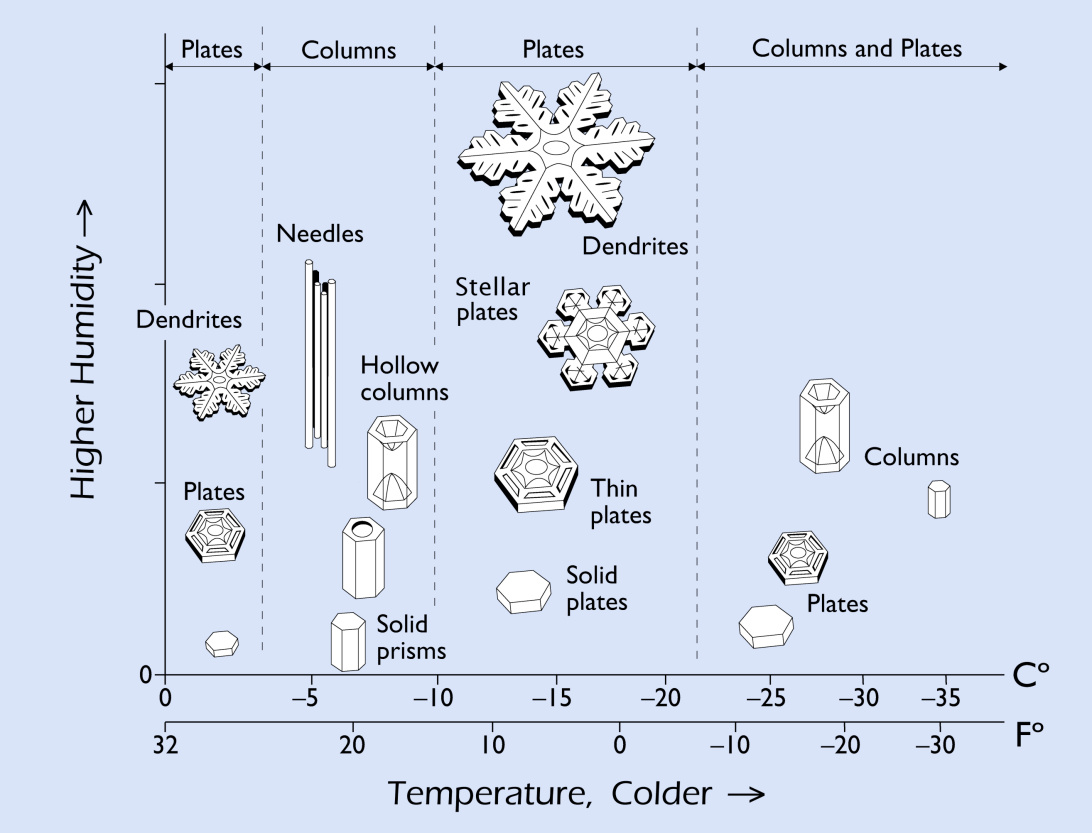
En nuestras investigaciones, realizamos simulaciones moleculares de la superficie del hielo, y demostramos que los cambios en el hábito de los cristales se podía correlacionar con cambios estructurales en las superficies de las caras basales y prismáticas. Los resultados los publicamos en:
- Llombart, Noya y MacDowell, Surface Phase Transitions and Crystal Habits of Ice in the Atmosphere, Science Advances, 2020.
Una cosa bonita de este trabajo es que es posible explicarlo con palabras sencillas, como en esta entrevista en el portal Cienciaes.
En esta línea de investigación también hemos estudiado algunos otros problemas relacionados:
¿Porqué es tan resbaladiza la superficie del hielo?
- Baran, Llombart, Rzysko y MacDowell, Ice Friction at the Nanoscale, 2022.
¿Cómo se forman gotas de agua sobre la superficie del hielo?
- Sibley, Llombart, Noya, Archer y MacDowell, How ice grows from premelting films and liquid droplets, Nature Communications, 2021.
¿Crece el hielo epitaxialmente?
- Llombart, Noya, Sibley, Archer y MacDowell, Rounded Layering Transitions on the Surface of Ice, Physical Review Letters, 2020.
Adsorción de Coloides sobre nanopartículas de oro.
Esta es una línea de investigación que hago con mis compañeros del grupo de Nano Química Física, centrado en las nanopartículas de oro y la nanoencapsulación.
Las nanopartículas de oro tienen propiedades ópticas muy especiales que dependen de su tamaño y de su forma. Cuando son muy pequeñitas no son de color amarillento, sino casi azules. Si crecen un poco más, se vuelven rojas. Y solo cuando son muy grandes adoptan el color amarillo. En el proceso de síntesis, es preciso recubrirlas con moléculas surfactantes. De lo contrario, se agregarían espontáneamente y perderían la forma deseada.
En colaboración con nuestro colega del departamento Andrés Guerrero, estudiamos cómo recubre el surfactante CTAB las nanopartículas de oro. Al contrario que lo esperado, en vez de recubrir el oro uniformemente, el CTAB se adsorbe en forma micelas hemiesféricas. Esta observación ayudó a entender mejor porqúe las nanopartículas irradiadas con pulsos láser en el laboratorio de Luis Bañares resultaban ser tan monodispersas:
- Guillermo González-Rubio et al. Femtosecond laser reshaping yields gold nanorods with ultranarrow surface plasmon resonances Science, 2017.
Si en vez de recubir las partículas de oro con CTAB únicamente, añadimos al sistema un co-surfactante quiral, como la binamina, entonces es posible transferir la quiralidad de las moléculas a las nanopartículas de oro, y formar nano-tornillos:
- Guillermo González-Rubio et al. Micelle-directed chiral seeded growth on anisotropic gold nanocrystals, Science, 2020.
Ondas capilares.
Cuando miramos la interfase del agua con su vapor, parece una superficie muy plana. Sinembargo, si miramos a una escala más pequeña, nos encontramos que se forman constantemente pequeñas olas microscópicas: son las ondas capilares. Midiendo la altura de las ondas, podemos averiguar muchas propiedades de la interfase y medir su tensión superficial. En nuestro trabajo, estudiamos películas líquidas adsorbidsa sobre un sustrato mediante técnicas de simulación molecular. El estudio arrojó una observación asombrosa: la tensión superficial no es constante, sino que depende del espesor de la película adsorbida.
- MacDowell, Benet y Katcho, Capillary waves and Film Height Dependent Surface Tension of Adsorbed Liquid Films", Physical Review Letters, 2013.
- Benet, Palanco, Sanz y MacDowell, Disjoining pressure, healing distance, and film height dependent surface tension of thin wetting films, Journal of Physical Chemistry C, 2014.
- MacDowell, Benet, Katcho y Palanco, Disjoining pressure and the film-height-dependent surface tension of thin liquid films: New insight from capillary wave fluctuations, Advances in Colloid and Interface Science, 2014.
Gracias a este conocimiento, es posible medir las fuerzas de atracción que se establecen entre partículas coloidales del tamaño del nanómetro unidas por un puente líquido:
- MacDowell, Llombart, Benet, Palanco y Guerrero-Martínez, Nanocapillarity and liquid bridge-mediated force between colloidal nanoparticles, ACS-Omega 2018.
